Prevalensi
Prevalensi tertinggi infeksi hepatitis B (yakni sekitar 48%) terdapat di Afrika, Pasifik Barat, dan negara-negara Asia, dimana virus biasanya ditransimikan secara perinatal dari ibu penderita hepatitis B kronik atau infeksi pada usia dini. Infeksi pada usia dini ini justru merupakan sebagian besar penyebab karsinoma hepatoselular pada negara-negara ini.
Sedangkan di negara Eropa Selatan dan Eropa Timur, prevalensi intermediate (2-7%), infeksi ditransmisikan secara perinatal, penggunaan jarum suntik bersama, transmisi nasokomial, tatto dan tindik. Di Eropa Barat, Amerika Utara, dan Australia, dimana Hepatitis B merupakan endemik rendah (52%), penularan terutama disebabkan kontak seksual dan pemakaian jarum suntik bersama.
Program vaksinasi Hepatitis B universal pada bayi baru lahir dan remaja telah dimulai untuk mengurangi prevalensi infeksi Hepatitis B tersebut
Patogenesis
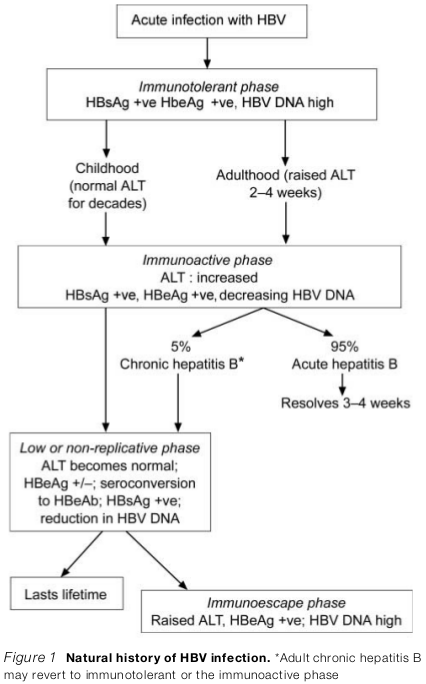
Perjalanan infeksi HBV dipengaruhi oleh interaksi antara replikasi virus dan respon imun tubuh.
Acute liver damage terutama disebabkan oleh respon imun yang protektif, yakni yang menghancurkan sel-sel liver yang telah terinfeksi virus. Jika respon imun tidak adekuat untuk melawan virus, maka infeksi akan menjadi kronik. Hal ini terjadi pada 95% kasus infeksi HBV perinatal, yang tanpa gejala akan menjadi kronik.
Infeksi perinatal dimulai dengan fase imunotoleran, yakni saat replikasi virus tinggi dengan kerusakan liver yang minimal. Dalam fase ini tes laboratorium yang diperlukan adalah marker HBsAg, HbeAg, dan HBV DNA; serum aminotransferase akan normal atau sedikit meningkat. Ada saatnya terjadi fase dimana respon imun terhadap virus akan dibentuk, yaitu fase imunoaktif yang dikarakteristikan dengan peningkatan serum aminotransferase (flare) dan supresi replikasi virus (serum HBV DNA akan menunjukkan penurunan). Munculnya flare berhubungan dengan peningkatan antibodi terhadap HbeAg, virus akan tersupresi oleh kekebalan tubuh, dan berlanjut ke fase non-replikatif yang ditandai dengan serum HbeAg undetected, munculnya anti-HBe, serum HBV DNA yang amat rendah, dan aminotransferase yang normal.
Beberapa pasien mengalami fase imunoescape dimana virus bermutasi menjadi varian yang tidak mengekspresikan HBeAg (HbeAg negatif chronic hepatitis). HBV DNA akan menunjukkan aktivitas replikasi yang tinggi dan berlanjutlah progresivitas penyakit livernya. Beberapa pasien menjadi negatif HbsAg dan fase final ini dinyatakan sebagai resolusi dari infeksi hepatitis B.
Pasien dewasa yang terinfeksi hepatitis B akan menjadi hepatitis akut yang dapat sembuh spontan. Namun 3-5% pasien akan mengalami hepatitis B kronik yang pola perkembangan penyakitnya mirip dengan infeksi hepatitis B kronik pada anak.
Pencegahan
Transmisi hepatitis B dapat dicegah dengan skrining darah donor, plasma, jaringan organ atau semen, produk plasma virus yang inaktif, konseling dan implementasi program kontrol infeksi. Namun dari semua itu pencegahan yang paling efektif adalah imunisasi rutin berkala pada bayi.
Imunisasi sebaiknya juga dilakukan pada pekerja kesehatan, orang dengan banyak pasangan seksual, pengguna jarum suntik, pasien dengan penyakit kronik yang butuh prosedur suntikan, dan orang yang kontak dengan pasien hepatitis B. Bayi-bayi baru lahir dari ibu yang memiliki carrier hepatitis (HBsAg positif) harus dilindungi dari infeksi perinatal dengan imunoglobulin B dan vaksin hepatitis B.
Diagnosis
Diagnosis hepatitis B kronik ditegakkan secara biokimia, virologis, dan histologis, serta eksklusi dari penyebab lain seperti hepatitis C. Tes fungsi liver secara rutin, deteksi antigen HBV (HBsAg & HBeAg), dan antibodi (anti-HBs, anti-HBc dan anti-HBe) harus dilakukan untuk mengetahui fase hepatitis B kronik. HBV DNA dapat dimonitor melalui DNA hibidrisasi dan amplifikasi untuk melihat aktivitas penyakit, pertimbangan untuk memulai terapi antiviral, dan melihat respon terapi. Biopsi liver penting untuk menegakkan diagnosis, mengidentifikasi penyakit liver lainnya, dan mengetahui staging fibrosis dan grading nekroinflamasi.
Terapi
Tujuan terapi hepatitis B kronik yaitu untuk menekan replikasi virus hepatitis B dan menginduksi remisi sebelum terjadinya sirosis dan karsinoma liver. Interferon rekombinan subkutan (10 MU 3x seminggu) dan lamivudine oral (100 mg 1x sehari) sudah digunakan di banyak negara lain dan adefovir (10 mg 1x sehari) sudah diizinkan untuk digunakan. Respon terapi dicapai bila HBV DNA undetected (5105 copy/mL) dalam serum, HBeAg negatif dengan atau tanpa anti-HBe (HBeAg serokonversi), dan perbaikan dari kondisi liver, serum aminotransferase normal, dan berkurangnya nekroinflamasi atau progresivitas fibrosis.
Kelebihan interferon adalah lama terapi yang relatif singkat, dan rendahnya tingkat resistensi; sedangkan kekurangannya adalah harga yang mahal, perlu suntikan subkutan, dan efek samping interferon itu sendiri. Lamivudine lebih ekonomis dan dapat ditoleransi tubuh dengan baik, namun dapat terjadi resistensi. Adefovir, dengan harga cukup mahal namun resistensi jarang terjadi.
Terapi tersebut tidak direkomendasikan pada pasien dengan hepatitis B kronik yang tidak aktif karena manfaat terapi yang tidak signifikan, namun pasien harus tetap dimonitoring.
Lalu, pasien mana yang sebaiknya mulai diberikan terapi?
American Association for Study of Liver Disease merekomendasikan pasien dengan HBeAg positif, serum aminotransferase meningkat (>2x nilai normal) harus diterapi: (i) 4-6 bulan interferon (10 MU 3x seminggu); atau (ii) 1 tahun penuh lemaivudine (100 mg 1x sehari, jika tidak ada infeksi HIV); atau (iii) 1 tahun penuh adefovir (10 mg 1x sehari). Oleh karena respon virus terhadap lamivudine atau adefovir tidak terpengaruh oleh kegagalan terapi dengan interferon, maka European Association for Study of Liver menyarankan penggunaan interferon terlebih dahulu.
Interferon dapat membuat HBeAg negatif pada 15-25% pasien, dan 80% akan bertahan 1 tahun setelah terapi. Lamivudine pada 10-15% pasien akan mengalami serokonversi HBeAg setelah 1 tahun dan respon virologis hampir pada semua pasien, tapi sayangnya 60% dari pasien akan mengalami relaps setelah 1 tahun terapi. resistensi obat terhadap lamivudine terjadi 20% saat tahun pertama terapi dan meningkat sampai 60% pada tahun ke-empat. Adefovir memiliki kemampuan serokonversi mirip dengan lamivudine namun respon terapi belum dapat dipastikan. Terapi dengan lamivudine dan adefovir harus dilanjutkan 4-6 bulan pasca serokonversi. jika tidak terjadi serokonversi setelah 1 tahun terapi oral, kelanjutan terapi tergantung dari kemampuan biaya terapi dan risiko resistensi obat yang meningkat.
Pasien dengan HBeAg negatif yang mempunyai nilai serum aminotransferase tinggi, hepatitis mild/severe, dan HBV DNA lebih dari 4105 copy/mL harus diterapu dengan interferon (selama 1 tahun) dengan lamivudine atau dengan adefovir. Jika mengalami resistensi lamivudine, HBV DNA dan serum aminotransferase rendah, maka lamivudine dapat dilanjutkan atau berhenti dan dimonitoring. Alternatif lain yaitu dengan adefovir.
Pasien dengan compensated-cirrhosis dan HBV DNA meningkat dapat diterapi dengan lamivudine atau adefovir, namun interferon dapat menyebabkan flare sehingga harus dihindari. Pasien dengan HBV DNA rendah atau tidak terdeteksi cukup dimonitoring saja. Pasien dengan decompensated-cirrhosis dengan HBV DNA tinggi harus melanjutkan terapi lamivudine atau adefovir sampai dilakukan transplant liver. Withdrawal lamivudine perlu dilanjutkan dengan adefovir karena jika tidak dapat menyebabkan dekompensasi liver. Jika viral load sudah tidak terdeteksi maka pasien segera direncanakan transplant liver.
Terapi antiviral ideal untuk hepatitis B kronik masih dalam penelitian. Pada sebagian besar pasien, monoterapi kurang efektif untuk mengeradikasi infeksi. Peginterferon alpha-2a masih dievaluasi dan dari data Phase II Trial dapat diperkirakan hasil dua kali lebih baik respon terapi (HBeAg loss, supresi HBV DNA, dan aminotransferase normal) dibandingkan dengan interferon konvensional setelah 24 minggu. Namun untuk ke depannya penanganan hepatitis B masih seputar manfaat dari terapi kombinasi dan atau terapi sekuensial dengan menggunakan agen oral atau interferon.
Referensi
- Gay N, Edmunds W, Bath E, et al. Estimating the Global Burden of Hepatitis B. Geneva: World Health Organization, Department of Vaccines and Biologicals, 2001
- Margolis HS, Alter MJ, Hadler SC. Hepatitis B: evolving epidemiology and implications for control. Semin Liver Dis 1991;11:84–92
- Kane MA. Global status of hepatitis B immunisation. Lancet 1996;348:696
- Sanchez-Tapias JM, Vilar JH, Costa J, et al. Natural history of chronic persistent hepatitis B. Relationship between hepatitis B virus replication and the course of the disease. J Hepatol 1984;1:15–27
- Fattovich G. Natural history of hepatitis B. J Hepatol 2003;39:S50–8
- Lok A, McMahon B. Chronic hepatitis B. Hepatology 2001;34:1225–41
- Lok A, McMahon B. ASLD guidelines. Chronic hepatitis B: update of recommendations. Hepatology 2004;39:857–61
- Craxi A, Bona DD, Camma C. Interferon alpha for HBeAg positive chronic hepatitis B: systematic review. J Hepatol 2003;39:S99–105
- Lai CL, Chien RN, Leung NW, et al. A one-year trial of lamivudine for chronic hepatitis B. N Engl J Med 1998;339:61–8
- Marcellin P, Chang TT, Lim SG, et al. Adefovir depivoxil for the treatment of hepatitis B e antigen positive chronic hepatitis B. N Engl J Med 2003;348:808–16
- Dienstag JL, Schiff ER, Wright TL, et al. Lamivudine as initial treatment for chronic hepatitis B in the US. N Engl J Med 1999;341:1256–63
- EASL Consensus Conference on Hepatitis B. J Hepatol 2003;39:S3–25
- Lok AS, Chung HT, Liu VW, Ma OC. Long-term follow-up of chronic hepatitis B patients treated with interferon alfa. Gastroenterology 1993;105:1833–8
- Villeneuve JP, Condreay LD, Willems B, et al. Lamivudine treatment for decompensated cirrhosis resulting from chronic hepatitis B. Hepatology 2000;31:207–10
- Cooksley WGE, Piratvisuth T, Wang Y, et al. 40 KDA peginterferon alfa-2a (PEGASYS(r)): efficacy and safety results from a phase II, randomized, multicenter study in the treatment of HBeAg positive chronic hepatitis B. Hepatology 2001;34:349A